O conhecimento do metabolismo do ácido úrico é necessário para entender como ocorrem as diversas doenças a ele relacionadas e para possibilitar o tratamento adequado. Sabemos que as alterações dos níveis séricos (relativo a soro), do ácido úrico para cima ou para baixo causam complicações como:
gota,
artrite úrica,
insuficiência renal aguda e/ou crônica,
cálculo renal, etc.
O ácido úrico é um produto do metabolismo das purinas (proteínas), por ação de uma enzima. Ele é um ácido fraco e a sua forma ionizada, o urato monossódico, é a forma encontrada no plasma humano, no líquido extra-celular e na sinóvia. A sinóvia é o líquido viscoso, que preenche as cavidades articulares.
Os alimentos contêm diversas substâncias constituídas por moléculas que são:
os açúcares (hidrato de carbono),
gorduras (ácidos graxos)
e proteínas (aminoácidos).
Os aminoácidos se decompõem no organismo em:
ácidos nucléicos,
nucleotídios
e bases purínicas.
As purinas estão presentes nos alimentos ingeridos e também em proteínas do nosso próprio organismo.
As purinas sofrem um processo de degradação em hipoxantina e esta se transforma em xantina. Por sua vez, a xantina, por ação irreversível de uma enzima denominada de xantina oxidase, se transforma em ácido úrico e este em urato de sódio. A maior parte dos uratos são produzidos no fígado provenientes do desdobramento das proteínas endógenas e exógenas. Vale ressaltar que a velocidade e a quantidade de ácido úrico formado a partir das purinas dependem da xantina oxidase, quanto maior for a quantidade desta enzima maior a formação de ácido úrico. Há defeitos familiares, como pequena produção da enzima que, herdados, podem influir na quantidade de ácido úrico formado.
Na evolução da nossa espécie, perdemos uma enzima produzida no fígado, a uricase e só nos restou a xantina oxidase. As aves, répteis e peixes que conservaram a uricase conseguem oxidar o urato em alantoina, uma substância 80 a 100 vezes mais solúvel que o urato e que é facilmente excretada pelo rim. Isto permite que esses animais tenham níveis muito baixos de ácido úrico.
Assim, as enzimas humanas, transformadoras das purinas, não são tão perfeitas como a uricase de outros animais; por isso, a taxa dos uratos do nosso organismo está no limite da solubilidade dos uratos, que é de 6,8 mg %, na temperatura normal do corpo humano. Os sais de urato de sódio são muito solúveis à temperatura de 37º C, mas se depositam com facilidade nas articulações periféricas, joelhos, tornozelos, calcanhares e artelhos do pé, nos quais a temperatura do corpo é mais baixa, provocando inflamações. Quando o ácido úrico é superior a 8 mg % no plasma sangüíneo, ele pode se depositar em qualquer tecido do organismo, dependendo muito das condições locais. Quando isso ocorre, pode surgir processo inflamatório como gota, artrite, tofo e nefrite.
As dosagens do ácido úrico no sangue e na urina de 24 horas são de grande valor para o diagnóstico das alterações do metabolismo do ácido úrico. Para uma coleta sanguínea adequada de ácido úrico, é necessário um jejum de pelo menos 4 horas antes do exame. Deve-se, também, suspender alguns medicamentos que podem alterar para índices mais altos o resultado do exame, como:
álcool,
vitamina C,
cafeína,
diuréticos,
teofilina e fenotiazidas.
Índices menores podem ocorrer quando se usa alopurinol, clofibratos, corticoides, estrógenos e anticoagulantes.
O ácido úrico é excretado para fora de nosso organismo pelo rim, bile e sucos intestinais. A taxa do ácido úrico no plasma humano depende do equilíbrio entre a absorção e produção de um lado e a destruição e excreção de outro lado.
De uma maneira geral, o organismo humano não é capaz de metabolizar ou destruir os uratos, por isso, para manter equilibradas e normais as taxas de ácido úrico no organismo, é necessário que ele seja eliminado pelo rim e/ou pelo intestino.
Por ser muito hidrossolúvel, o urato é facilmente eliminado pelo rim em quantidades de 600-700 mg/dia nas dietas normais. Num indivíduo normal, 1/3 do ácido úrico é degradado e excretado pelo intestino e 2/3 pelo rim.
Na falência do rim, a degradação e eliminação do ácido úrico são extremamente aumentadas pelo intestino. A degradação é provocada pelas bactérias intestinais, que pode atingir até 80 % da excreção diária de ácido úrico.
Quando o ácido úrico está aumentado no sangue, dizemos que há hiperuricemia e, quando as taxas se encontram diminuídas, se diz que há hipouricemia.
Veremos, a seguir, mais detalhes sobre essas duas alterações do ácido úrico.
HIPOURICEMIA
Considera-se que há hipouricemia, quando o ácido úrico plasmático é inferior a 2,5 mg%. É uma síndrome clínica assintomática com várias causas, pouco conhecida. A hipouricemia deve ser investigada e tratada para evitar conseqüências desagradáveis como a formação de cálculos de ácido úrico, que ocorre pelas grandes perdas renais de uratos. A hipouricemia pode ser primária (permanente) ou adquirida (intermitente).
A hipouricemia primária ocorre em casos hereditários ou quando há grandes perdas de xantina pela urina (hiperxantinúria). A perda de xantina diminui muito o material necessário para a transformação de xantina em ácido úrico e, como conseqüência, ele está diminuído no plasma.
Na hipouricemia adquirida, o ácido úrico está muito baixo porque é eliminado em grandes quantidades pela urina. Isto pode ocorrer pelo uso de substâncias uricosúricas que aumentam a perda de ácido úrico pela urina como aspirina em altas doses, benziodarona, citrato, probenecide, ácido ascórbico, estrógenos e outros. Outro tipo de hipourecemia adquirida ocorre com o uso indiscriminado e não controlado de alopurinol, substância inibidora da ação da enzima xantina oxidase, que transforma a xantina em ácido úrico.
O tratamento da hipouricemia é evitar as causas que levam à diminuição de ácido úrico plasmático.
HIPERURICEMIA
A hiperuricemia é o termo referente ao estado sangüíneo no qual o ácido úrico no plasma (soro) está acima de 6 mg% nas mulheres e 7 mg% nos homens. De uma maneira geral, os homens hiperuricêmicos têm o início da elevação do ácido úrico na puberdade, mas os sintomas clínicos surgem de 10 a 20 anos após. A hiperuricemia ocorre em 10-15% da população acima de 40 anos. Geralmente assintomática, a hiperuricemia está relacionada a outras doenças, como:
a acidose metabólica,
alcoolismo,
diabete,
gota,
hipertiroidismo,
toxemia gravídica,
policitemia,
leucemia,
uso abusivo de diuréticos
e, em certos casos, de cálculos renais.
Também ocorre na ingesta exagerada de proteínas (purinas) e nos exercícios extenuantes. Para explicar a razão por que o ácido úrico está correlacionado à hiperglicemia, descobriu-se que níveis elevados de ácido úrico aumentam a resistência de nossos tecidos à ação da insulina. Por isso, é freqüente ocorrer hiperuricemia e hiperglicemia.
A hiperuricemia pode ocorrer por superprodução ou por diminuição da excreção renal e intestinal de ácido úrico. A deficiência de excreção urinária de uratos é responsável por 85 a 90% das hiperuricemias primárias e secundárias. A hiperuricemia costuma ocorrer mais nos homens a partir da puberdade, com maior incidência na faixa entre 30-40 anos e nas mulheres, na menopausa. Os estrógenos aumentam a depuração do acido úrico e, por isso, não é comum encontrar hiperuricemia nas mulheres antes da menopausa.
A hiperuricemia pode ser de duas categorias:
Primária
e Secundária
É primária quando o ácido úrico está elevado no sangue independente de doenças coexistentes ou drogas que alterem a produção e excreção dos uratos. Secundária, quando a elevação se deve a doenças existentes, drogas e dietas que alteram a produção e excreção de ácido úrico. Um exemplo de drogas que influem nas taxas de ácido úrico são os diuréticos, principalmente, tiazídicos e furosemide, que causam um aumento nos níveis de ácido úrico em torno de 2-3mg% nos pacientes que os usam. O aumento reflete uma diminuição da excreção urinária de ácido úrico provocado pelo efeito do diurético. Na grande maioria dos pacientes que usam diuréticos, esse aumento não tem grande importância, mas é problemático nos que têm predisposição para gota, podendo ser responsável pelo desencadeamento de crises gotosas.
A hiperuricemia, em 75% dos pacientes, é assintomática, pois o paciente não apresenta nenhum sintoma seja artrite, gota, tofo ou litíase. Nos restantes 25%, podem ocorrer sintomas como: gota, artrite, litíase (cálculos renais), doenças renais (nefrite) e formação de depósitos de ácido úrico, formando os tofos.
A hiperuricemia assintomática costuma ocorrer freqüentemente com:
abuso sistemático do álcool,
obesidade
e uso crônico de drogas que inibem a excreção de ácido úrico, antiinflamatórios e diuréticos.
A presença de hiperuricemia é associada a fatores de risco cardiovascular como:
hipertensão arterial,
hiperlipidemia,
diabete
e alterações vasculares coronárias. (Vide mais detalhes sobre hiperuricemia no capítulo gota e rim).
A hiperuricemia poderá apresentar-se, clinicamente, sob a forma de:
gota,
artrite,
doença úrica renal aguda ou crônica
e litíase (ver ácido úrico e doenças renais).
Tratamento da hiperuricemia
A hiperuricemia é um fator de risco para as doenças cardio-vasculares e renais; por isso, é necessário que o ácido úrico plasmático se mantenha normal. Para isso, é necessário que o médico procure as causas do aumento e oriente o tratamento adequado. Pode ocorrer um ataque agudo articular, provocando a artrite úrica (gota). Neste caso, deve-se usar antiinflamatórios e analgésicos nas crises de dor. Quando há superprodução de ácido úrico devem ser usadas substâncias hipourecemiantes pelo bloqueio da enzima xantina-oxidase.
No paciente que elimina mal o ácido úrico pelo rim podem ser usados os uricosúricos que aumentam a excreção renal de uratos. Com a diminuição da produção e aumento da excreção dos uratos, se faz a profilaxia das recorrências de artrite, gota, nefrite e cálculos renais. Há fatores predisponentes que devem ser excluídos como:
o uso abusivo e constante de álcool, dietas inadequadas e medicações que diminuem a excreção urinária de uratos como, diuréticos, antinflamátorios e outros.
Um ponto fundamental do tratamento é manter o ácido úrico abaixo do normal por um tempo nunca inferior a 6 meses para que os uratos sejam desmobilizados dos tecidos e ossos, evitando a deposição dos cristais
A dieta é um item importante do tratamento do ácido úrico, mas não o único. Os alimentos não recomendados e que devem ser evitados pelos pacientes com hiperuricemias são aqueles ricos em purinas, como:
as carnes,
miúdos (fígado, coração, língua e rins),
peixes pequenos,
frutos do mar como as sardinhas, arenque, anchova, mexilhão, camarão e ovas de peixes.
Os caldos e ensopados devem ser evitados porque o ácido úrico é muito hidrossolúvel e quando qualquer tipo de carne é cozido em água, o ácido úrico se difunde e se concentra nos líquidos de cozimento.
Certos grãos como feijão, grão de bico, ervilha, lentilha e grãos integrais têm muita purina e devem ser evitados.
Para finalizar, cabe dizer que toda a dieta, por melhor que seja, só pode reduzir em 25% os valores plasmáticos do ácido úrico. Isso ocorre em aproximadamente 10 dias após o início da dieta.
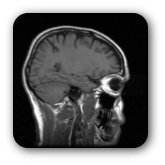 O acidente vascular cerebral é uma doença caracterizada pelo início agudo de um deficit neurológico (diminuição da função) que persiste por pelo menos 24 horas, refletindo envolvimento focal do sistema nervoso central como resultado de um distúrbio na circulação cerebral; começa abruptamente, sendo o deficit neurológico máximo no seu início podendo progredir ao longo do tempo.
O acidente vascular cerebral é uma doença caracterizada pelo início agudo de um deficit neurológico (diminuição da função) que persiste por pelo menos 24 horas, refletindo envolvimento focal do sistema nervoso central como resultado de um distúrbio na circulação cerebral; começa abruptamente, sendo o deficit neurológico máximo no seu início podendo progredir ao longo do tempo. 
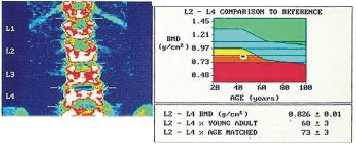
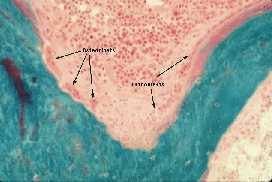 No início de cada ciclo de remodelamento os osteoclastos escavam o osso, formando lacunas na sua superfície e cavidades no seu interior. Após cerca de duas semanas os osteoclastos são deslocados pelos osteoblastos que em um período aproximado de três meses preenchem a área absorvida com osso novo.
No início de cada ciclo de remodelamento os osteoclastos escavam o osso, formando lacunas na sua superfície e cavidades no seu interior. Após cerca de duas semanas os osteoclastos são deslocados pelos osteoblastos que em um período aproximado de três meses preenchem a área absorvida com osso novo.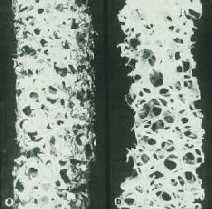 Além desta fase lenta de perda de massa óssea, as mulheres têm um período transitório de perda rápida de osso no qual a queda de estrógenos circulantes, que ocorre desde a pré-menopausa, desempenha papel importante. O período transitório de perda rápida pode se manter por 4 a 8 anos, nos quais a perda óssea chega até a 2% ao ano. O osso trabecular é metabolicamente mais ativo e mais responsivo às alterações do funcionamento do organismo o que pode explicar porque, neste tipo de osso, a perda óssea inicia-se, em ambos sexos, na terceira década e a massa total de osso declina 6 a 8% a cada 10 anos. Também a resposta à queda estrogênica é mais intensa, havendo grande aceleração do remodelamento ósseo e perda de 5 a 10% de massa óssea ao ano em 40% das mulheres - osteoporose da pós-menopausa.
Além desta fase lenta de perda de massa óssea, as mulheres têm um período transitório de perda rápida de osso no qual a queda de estrógenos circulantes, que ocorre desde a pré-menopausa, desempenha papel importante. O período transitório de perda rápida pode se manter por 4 a 8 anos, nos quais a perda óssea chega até a 2% ao ano. O osso trabecular é metabolicamente mais ativo e mais responsivo às alterações do funcionamento do organismo o que pode explicar porque, neste tipo de osso, a perda óssea inicia-se, em ambos sexos, na terceira década e a massa total de osso declina 6 a 8% a cada 10 anos. Também a resposta à queda estrogênica é mais intensa, havendo grande aceleração do remodelamento ósseo e perda de 5 a 10% de massa óssea ao ano em 40% das mulheres - osteoporose da pós-menopausa.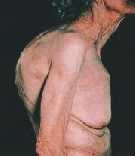 O dorso curvo (cifose dorsal) é característico e escoliose (curvatura lateral) lombar e dorsal aparecem com grande freqüência. Com a progressão da cifose dorsal há projeção para baixo das costelas e conseqüente aproximação à bacia, provocando dor local que pode ser bastante incômoda. Nos casos mais avançados, a inclinação anterior da bacia leva a alongamento exagerado da musculatura posterior de membros inferiores e contratura em flexão dos quadris e consequentes distúrbios para caminhar, dor articular e em partes moles. Compressão de raíz nervosa é muito rara.
O dorso curvo (cifose dorsal) é característico e escoliose (curvatura lateral) lombar e dorsal aparecem com grande freqüência. Com a progressão da cifose dorsal há projeção para baixo das costelas e conseqüente aproximação à bacia, provocando dor local que pode ser bastante incômoda. Nos casos mais avançados, a inclinação anterior da bacia leva a alongamento exagerado da musculatura posterior de membros inferiores e contratura em flexão dos quadris e consequentes distúrbios para caminhar, dor articular e em partes moles. Compressão de raíz nervosa é muito rara.